胚胎移植是现代辅助生殖技术的核心环节,其实质是生命科学、细胞生物学与临床医学的深度融合。这项技术通过体外受精形成胚胎后,将其精准植入母体子宫内,模拟自然妊娠的早期过程。从细胞层面来看,移植过程需要确保胚胎处于合适的发育阶段——通常选择囊胚期(受精后5-6天),此时的胚胎已分化出滋养层细胞和内细胞团,具备更强的着床能力。
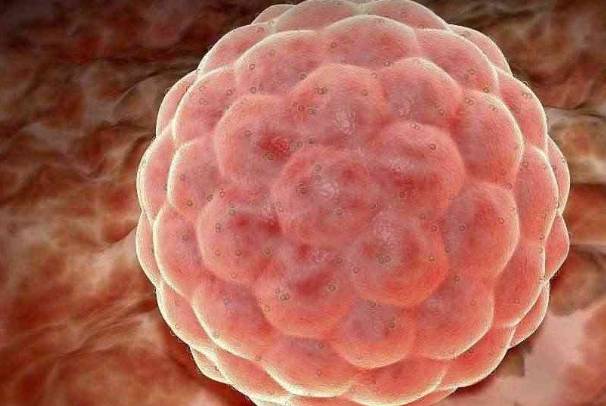
医学研究表明,胚胎与子宫内膜的同步化是成功关键。临床中会通过激素药物调控患者子宫内膜厚度至8-12毫米的黄金区间,同时监测血液中孕酮及雌二醇水平,确保胚胎着床窗口期与移植时间完全匹配。这种时空精准性要求,使得胚胎移植远超出简单"放置"的概念,而是一场精密调控的生命接力。
临床操作中的技术实现路径
标准化的胚胎移植流程包含三大核心步骤:胚胎质量评估、移植导管操作和术后黄体支持。胚胎学家会通过形态学评分系统(如Gardner分级法)筛选发育潜能最佳的胚胎,借助显微操作技术去除透明带残留物质。移植时使用特制软性导管,在超声引导下避开宫颈黏液和宫腔褶皱,将胚胎定位于宫腔中上1/3处的"黄金区域"。
近年发展的时差成像系统(Time-lapse)可通过持续监测胚胎分裂模式,预测染色体异常风险。玻璃化冷冻技术的成熟使冻胚移植周期成功率反超鲜胚,这归功于冷冻过程能规避卵巢过度刺激带来的内膜容受性下降问题。操作医生需根据患者个体差异,在移植数量与多胎风险间取得平衡。
影响移植成功率的本质因素
胚胎质量与子宫容受性的"双重匹配"是决定移植成功的生物学本质。
年龄因素直接关联卵子线粒体功能,35岁以上女性胚胎非整倍体率可达40%-60%。
子宫内膜血流灌注情况通过三维超声可量化评估,血流阻力指数(RI)低于0.7时着床率显著提升。
免疫微环境中的自然杀伤细胞(NK细胞)活性、调节性T细胞比例等指标,正成为新的研究焦点。
临床数据显示,经过基因筛查(PGT-A)的胚胎移植后临床妊娠率可达65%-70%,但需注意技术本身不能改善胚胎发育潜能。心理压力导致的皮质醇水平升高可能改变子宫收缩频率,这解释了为何心理干预组的妊娠成功率平均高出12%。这些发现凸显胚胎移植不仅是技术操作,更是对生命系统的整体调控。