GemVax在Neuro2024大会上发布进行性核上性麻痹2a期临床试验顶线结果
http://www.qm120.com2024-10-30 14:00:09 来源:全民健康网作者:美通社 PR Newswire
 |
——顶线数据支持进入3期试验,且显示GV1001有望成为全球首款PSP治疗药物
韩国首尔2024年10月30日 /美通社/ -- 当地时间10月24日下午4点45分,GemVax & KAEL Co., Ltd.(简称"GemVax";KOSDAQ股票代码:082270)在加拿大多伦多举办的"Neuro2024:PSP和CBD国际研究研讨会"上公布了其治疗进行性核上性麻痹(PSP)的研究用药物GV1001的2a期临床试验(简称"2a期PSP临床试验")的顶线结果。
PSP是一种退行性疾病,与帕金森病一样,也会导致步态障碍、早期跌倒、垂直性凝视麻痹、僵直、震颤和认知能力下降等症状,但其病程进展更快,目前尚无根治手段。PSP分为多种类型,包括PSP-理查森综合征(PSP-RS)和PSP-帕金森综合征(PSP-P)。相较于其他类型,PSP-RS型表现出更为显著的tau蛋白聚集,且影响范围更广,涉及小脑、齿状核、桥脑核、额叶及顶叶等区域。
2a期PSP临床试验是一项为期24周的随机、双盲、安慰剂对照前瞻性探索性临床试验,在韩国5个研究中心共招募了78名PSP患者。参与者按1:1:1的比例随机分配,分别接受安慰剂、0.56毫克GV1001或1.12毫克GV1001治疗。治疗方案为前4周(1个月)每周一次皮射,随后每2周注射一次,持续20周(5个月),总共为期24周(6个月)。该试验面向PSP-RS和PSP-P两种类型的患者开放。试验结果显示,低剂量组(0.56毫克)疗效更为显著,尤其对PSP-RS型患者效果更佳。
试验的主要终点是使用GV1001治疗24周后PSP评分量表总分(采用MMRM法计算的最小二乘均数)较基线的变化。结果显示,0.56毫克剂量组病情恶化2.14分,而安慰剂组4.10分,说明疾病进程减缓了48%(见图1)。尽管未达统计学显著差异,但这些发现仍揭示了GV1001治疗目前无法治愈的PSP的潜力,并为推进GV1001至更高级别临床试验提供了依据。
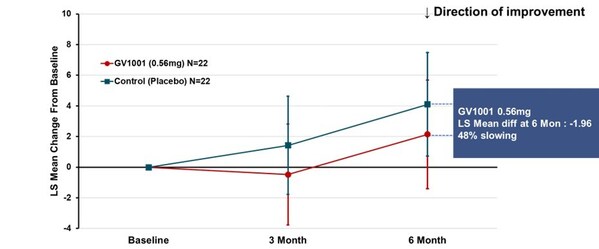
Figure 1. PSP-Rating Scale Total Score (PSP-RS Type + PSP-P Type_ LS mean using MMRM)
临床上,多数PSP患者属于典型的PSP-RS型,这一类型较其他PSP类型病程进展更快,平均生存期也更短。试验专门针对PSP-RS型患者进行了分组分析。在服用GV1001二十四周后,采用简单平均法计算PSP评分量表总分均值的变化,结果显示,0.56毫克剂量组病情恶化平均分为0.25分,而安慰剂组为5.19分,两组相差4.94分,说明疾病恶化程度降低了95%(见图2)。
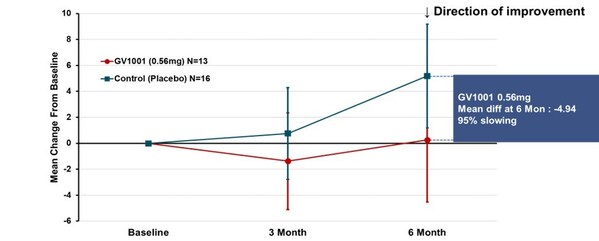
Figure 2. PSP-Rating Scale Total Score (PSP-RS Type_ simple average)
治疗组中多数PSP-RS型患者在试验期间症状保持稳定甚至有所改善。以治疗6个月后PSP评分量表总分与基线相比有所改善或保持稳定的患者比例来计算缓解率,0.56毫克GV1001组有58.33%的PSP-RS型患者症状得到了改善或稳定(见图3)。
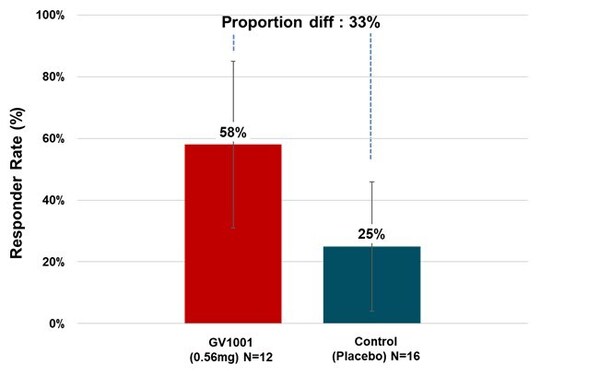
Figure 3. Responder Rate (PSP-RS Type)
在2a期PSP临床试验中,GV1001的安全性表现与之前的数据相符,整体耐受性良好,未观察到与药物相关的严重不良事件。
GemVax首席战略官Hyungsik Moon指出:"本次2a期试验属于探索性研究,旨在确定最优剂量及对不同分组的效果。尽管顶线结果未达到统计学显著性,但所提供的证据已充分支持我们考虑推进至关键性试验,同时表明GV1001有望成为全球首个PSP治疗方案。"
出席Neuro2024会议的专家对PSP试验结果表示欢迎,认为成果振奋人心,并对该药即将迈入全球3期临床试验进行更深入的研发感到高兴。
全球CRO ICON药物开发高级副总裁、医学博士Peter Schüler表示:"这项试验性研究并非完全有效,且6个月的治疗周期相对较短,因此无法预期获得具有统计学意义的确证结果。不过,在运动表现和认知功能这两个领域,我们观察到的趋势既合理又一致,均显示出低剂量组的优势。"
Schüler博士表示:"本次试验确定了最佳剂量,这也是2a期研究的主要目标之一,并展现了与安慰剂组相比,病情完全稳定这一具有临床意义的好处。这些顶线数据为推进至3期研究提供了有力的依据。"
慕尼黑大学附属医院(LMU Hospital)神经科主任、全球知名PSP专家Günter U. Höglinger博士评价道:"在全新作用机制的新药研究中,我们获得了极为振奋的2期临床数据。尽管数据尚属初步,但前景广阔,且与[GV1001]在阿尔茨海默病中的临床数据相契合。我对接下来的研发充满期待,并很荣幸能参与并领导[PSP]的3期研究。"
CurePSP主任Kristophe Diaz博士表示:"GemVax最近的临床试验结果令人振奋,为整个PSP群体,包括目前尚无治疗选择的患者、家属及治疗他们的医生,带来了希望。我们祝贺GemVax成功完成试验,并期待其能继续为PSP社群带来更多福祉。"他还强调:"CurePSP将一如既往地致力于合作,支持为这一毁灭性疾病患者带来希望与成果的各项工作。"
下载PDF:https://mma.prnewswire.com/media/2542940/2024_10_29__GemVax_Announces_Topline_Results.pdf
关于2a期PSP临床试验(NCT05819658)
2a期PSP临床试验是一项为期24周的多中心、随机、双盲、安慰剂对照前瞻性探索性临床研究,旨在评估0.56毫克或1.12毫克GV1001与安慰剂相比在治疗PSP患者上的安全性和疗效。主要终点为使用GV1001治疗24周后,PSP评分量表总分相对于基线的变化。次要终点则包括3个月时PSP评分量表总分以及3个月和6个月时MoCA-K、K-FAB和ES-ADL评分相对于基线的变化。此外,研究还全面评估了GV1001的总体安全性。
关于GV1001
GV1001是一种合成肽,由16个氨基酸构成,以端粒酶的关键序列为基础。它已被研究用于治疗包括阿尔茨海默病和PSP在内的神经退行性疾病。研究显示,GV1001能够调节神经胶质细胞的表型并减轻神经炎症。除了正在进行的2a期PSP临床试验外,针对阿尔茨海默病的2期临床试验也正在美国和欧洲同步推进(NCT05189210)。
关于PSP
进行性核上性麻痹是一种罕见的、成年后发病的进行性神经退行性疾病,目前尚无药物能改变其病程。全球发病率约为每十万人中有七例,且男性更为常见。患者多为60岁以上的老年人。PSP的症状包括平衡感丧失、性格变化、眼球活动无力(尤其是向下看时)、吞咽困难、言语不清以及认知功能受损。
关于GemVax & KAEL
GemVax & KAEL Co., Ltd.是韩国一家处于临床阶段的生物制药先锋企业,专注于研发治疗神经退行性疾病(如进行性核上性麻痹和阿尔茨海默病)的专利疗法。针对PSP,GemVax正在韩国进行2a期研究,以评估GV1001对PSP患者的疗效与安全性,同时也在筹备全球性的PSP临床试验。此外,公司目前还在美国和欧洲同步开展阿尔茨海默病的2期临床试验。欲了解更多信息,请访问www.gemvax.com并在Linkedin上关注我们。
前瞻性陈述
本文件所含信息包括或基于《1995年证券诉讼改革法案》界定的"前瞻性陈述"。这些陈述可能使用"计划"、"将要"、"预计"、"预测"、"打算"、"相信"、"潜力"、"继续"等明确标识词,或其他类似表述,也可能不使用。此类陈述受已知和未知风险及不确定性的影响,可能导致实际结果与陈述中明示或暗示的结果有重大出入。这些风险和不确定性包括但不限于:药物研发的固有挑战(如临床前和临床项目的时间安排和结果,这些项目因高风险而可能在任何阶段失败,包括监管审批前后因疗效不佳、安全性问题或其他因素导致的失败);我们利用和加强药物发现平台的能力;我们为开发活动和其他企业目的筹集资金的能力;我们合作项目的成败;我们获得监管批准并最终实现药物候选产品商业化的能力;我们获取、维持和落实知识产权保护的能力;我们的技术系统遭受网络攻击或其他干扰的风险;我们吸引、激励和留住关键人才以及管理增长的能力;通货膨胀和其他宏观经济问题;以及其他风险和不确定性。所有前瞻性陈述均基于管理层当前的估计、预测和假设,除非法律另有要求,GemVax不承担更正或更新这些陈述的义务,无论是因为新信息的出现、未来事态的发展还是其他原因。
本文RSS来源:美通社
- 招商信诺全力护航2024闻泰安世上海10公里精英赛
- 罗氏七赴进博,深耕中国三十周年,聚力共筑健康未来
- 海尔生物医疗获TÜV南德全球首张医用冷藏箱DIN 13277认证证书
- 再赴进博:欧姆龙FORPHEUS机器人生动诠释"人机和谐"新境界
- 泓格生医将于2024 COMPAMED展示最新研发TPU材料──推动医疗保健创新与进步
- 65%生物制剂治疗应答不佳患者实现皮损清除,匹康奇拜单抗(IL-23p19抗体)II期银屑...
- 三叶草生物公布其二价 RSV 候选疫苗 SCB-1019 与 GSK RSV 疫苗 ARE...
- IDWeek 2024 | 四项康替唑胺/康替唑胺磷酸盐研究成果以壁报形式展示
- 司普奇拜单抗52周研究数据发表于过敏与免疫学顶级期刊《Allergy》
- "皮肤守护之旅 共筑健康生态"皮肤健康公益行系列活动正式启动